Sie sind selten und kommen bei Kindern sowohl im Gehirn als auch im Rückenmark vor: Tumoren mit dem Namen Ependymome. Aus der Arbeitsgruppe von Prof. Ulrich Schüller am Forschungsinstitut Kinderkrebs-Zentrum Hamburg haben nun drei Wissenschaftlerinnen richtungsweisende Ergebnisse erzielt, mit denen diese Tumoren zukünftig besser diagnostiziert und gezielter therapiert werden können.
Ependymome machen bei Kindern knapp fünf Prozent aller Tumoren des zentralen Nervensystems aus. Die Tumorzellen entwickeln sich aus Ependymzellen, diese kleiden die Innenwände der Hirnkammern und des Rückenmarkskanals aus. Wirksame Behandlungsmethoden beschränken sich zurzeit auf das vollständige operative Entfernen des Tumors und Strahlentherapie. Wobei man insbesondere bei kleinen Kindern versucht, ihr Gehirn nicht zu bestrahlen, um keine bleibenden Schäden zu verursachen. Erkenntnisse, die helfen diese Tumoren besser einzuordnen und ihre weitere Entwicklung vorherzusagen, sind unverzichtbar, um die Behandlung für jeden Patienten so schonend und wirksam wie möglich zu gestalten.
Bei spinalen Ependymomen (SP-EPN) gibt es hier nun mehr Klarheit. Dr. Sina Neyazi untersuchte diese im Rückenmark vorkommenden Tumoren und fand heraus, dass es zwei Subtypen gibt, die unterschiedlich verlaufen. Bei einem Subtyp A treten eher Rezidive auf, das heißt, dass der Tumor zurückkommt, beim Subtyp B ist ein Rückfall hingegen unwahrscheinlich. Die beiden Subtypen unterscheiden sich auf molekularer Ebene. Unter anderem treten beim schlechter verlaufenden Subtyp A bestimmte Veränderungen des Erbguts auf, sogenannte NF2-Mutationen, beim Subtyp B findet man diese Mutationen nicht oder nur selten.
Wie sich solche neuen Erkenntnisse im Klinikalltag niederschlagen, verdeutlicht Prof. Ulrich Schüller: „An diesen Rückenmarks-Tumoren stirbt keiner. Aber was sage ich den Eltern, nachdem der Tumor operativ entfernt wurde? Sollen sie in einem halben, einem oder zwei Jahren wieder kommen, um ihr Kind untersuchen zu lassen? Oder ist von so einem guten Verlauf auszugehen, dass sie sich nur vorstellen müssen, wenn erneut Beschwerden auftreten?“
Mit den Ergebnissen von Neyazi kann der Krankheitsverlauf mithilfe einer molekularen Analyse des Tumorgewebes nun wesentlich klarer eingeordnet werden. Auch für die Entwicklung neuer Behandlungsstrategien sind detaillierte Einblicke in die molekularen Eigenschaften dieser Tumoren unverzichtbar.
Lara Pohl untersuchte in ihrer Arbeit 2.023 Datensätze von Ependymomen. Damit hat sie einen Datensatz geschaffen, der zuverlässige Informationen darüber liefert, wie sich bestimmte molekulare Merkmale auf den weiteren Verlauf der Tumorerkrankung und die Überlebensrate auswirken.
Eine vergleichbare Analyse fand zuletzt 2015 statt, wobei diese nur 500 Proben umfasste, sodass damals einige Tumorklassen noch fehlten. Pohl konnte nun fehlende Daten ergänzen., damals gewonnenen Erkenntnisse überprüfen und Unterschiede zwischen den einzelnen Subtypen der Ependymome untersuchen. „Unsere Daten sind insbesondere für seltene und kaum erforschte Tumorsubtypen und scheinbar gutartige Varianten relevant, die höhere Rückfallraten aufweisen als bisher angenommen“, so Schüller. Die Untersuchung förderte auch neue Erkenntnisse zu einzelnen Tumorsubklassen zutage, etwa dass bestimmte Ependymome, die man bislang nur im Großhirn vermutete, auch im Kleinhirn vorkommen.
Die Rohdaten dieser umfangreichen Ependymom-Analyse sind im Internet vollständig verfügbar, andere Wissenschaftler können sie sich aus dem Netz herunterladen. Damit wurde eine wertvolle Ressource für weitere Forschungsarbeiten geschaffen.
Pohl und ihre Kollegen entwickelten zudem ein Machine-Learning-Modell, mit dem basierend auf bestimmten molekularen Eigenschaften einer Tumorprobe, dem sogenannten Methylierungsprofil, vorhergesagt werden kann, wie die Tumorerkrankung verlaufen wird. Daraus könnte sich ein direkteres und personalisiertes Diagnoseinstrument für die klinische Praxis entwickeln.
Ependymome der hinteren Schädelgrube Typ A (PF-EPN-A, PFA) verlaufen oftmals schlecht, über die Hälfte der Patienten überlebt die Erkrankung nicht. Meistens treten sie bei kleinen Kindern im Alter zwischen zwei und fünf Jahren auf. Swenja Gödicke, wie Lara Pohl ebenfalls Medizinstudentin am Universitätsklinikum Hamburg-Eppendorf (UKE), fand heraus, dass sich die Zelldichte innerhalb eines Tumors bei diesen Ependymomen unterscheidet. Eine hohe Zelldichte geht dabei mit einem schlechteren Verlauf der Tumorerkrankung einher.
Die bereits unter dem Mikroskop sichtbaren Unterschiede zwischen Bereichen mit hoher und niedriger Zelldichte der Tumor-Gewebeschnitte finden sich auf molekularer Ebene wieder. So kamen für diesen Tumor charakteristische Chromosomenveränderungen, die für eine schlechte Prognose sprechen, in zelldichten Bereichen häufiger vor. Auch Gewebeproben aus Rezidiven, also aus erneut aufgetreten PF-EPN-A, wiesen vermehrt zelldichte Bereiche auf.
Die Ergebnisse der Hamburger Forscherin zeigen erstmals, wie wichtig es für die Beurteilung dieses Hirntumors ist, die Anzahl zelldichter Bereiche zu ermitteln und die molekularen Analysen aus diesen Bereichen vorzunehmen.
„Mit diesen drei Arbeiten konnten wir wertvolle neue Beiträge leisten zur Klassifikation von Ependymomen. Sie sind übrigens auch das Ergebnis jahrelanger referenzpathologischer Tätigkeit, im Rahmen derer wir Ependymome aus ganz Deutschland zur Beurteilung nach Hamburg zugeschickt bekommen", so Prof. Schüller.
Originalpublikationen
Neyazi, S., Yamazawa, E., Hack, K. et al. Transcriptomic and epigenetic dissection of spinal ependymoma (SP-EPN) identifies clinically relevant subtypes enriched for tumors with and without NF2 mutation. Acta Neuropathol 147, 22 (2024). https://doi.org/10.1007/s00401-023-02668-9
Pohl, L.C., Leitheiser, M., Obrecht, D. et al. Molecular characteristics and improved survival prediction in a cohort of 2023 ependymomas. Acta Neuropathol 147, 24 (2024). https://doi.org/10.1007/s00401-023-02674-x
Gödicke, S., Kresbach, C., Ehlert, M. et al. Clinically relevant molecular hallmarks of PFA ependymomas display intratumoral heterogeneity and correlate with tumor morphology. Acta Neuropathol 147, 23 (2024). https://doi.org/10.1007/s00401-023-02682-x
Wissenschaftlicher Ansprechpartner
Prof. Ulrich Schüller, Forschungsinstitut Kinderkrebs-Zentrum Hamburg, schueller@kinderkrebs-forschung.de
Pressekontakt
Forschungsinstitut Kinderkrebs-Zentrum Hamburg
Gebäude N 63
Martinistr. 52
20251 Hamburg
E-Mail: presse@kinderkrebs-forschung.de
Über das Forschungsinstitut Kinderkrebs-Zentrum Hamburg
Das Forschungsinstitut Kinderkrebs-Zentrum Hamburg wurde im Jahr 2006 von der Fördergemeinschaft Kinderkrebs-Zentrum Hamburg e.V. mit Spendengeldern gegründet. Am Institut erforscht ein multidisziplinäres Team von rund 50 klinisch tätigen Ärzt:innen, Naturwissenschaftler:innen, technischen Assistent:innen und engagierten Mitarbeitenden die molekularen Entstehungsmechanismen der Krebserkrankungen bei Kindern, um neue Ansätze für bessere und zielgenaue Therapien zu entwickeln. Spenden, Patenschaften und privates Engagement ermöglichen die Forschungsarbeit. Das Institut wird von einem wissenschaftlichen Beirat begleitet und arbeitet eng mit dem Universitätsklinikum Hamburg-Eppendorf (UKE) sowie dem Leibnitz-Institut für Virologie (LIV) zusammen. Durch die Kooperation mit nationalen und internationalen Forschungseinrichtungen sowie mit der klinischen Patientenversorgung am UKE werden optimale Voraussetzungen für eine erfolgreiche Behandlung von krebskranken Kindern geschaffen. Rund die Hälfte der Projektkosten werden durch kompetitive Drittmittel gedeckt – unter anderem von der Deutschen Forschungsgemeinschaft, der Deutschen Krebshilfe, dem Bundesministerium für Bildung und Forschung sowie der Europäischen Union.
Über Krebs im Kindesalter
In Deutschland erkranken jährlich circa 2.200 Kinder und Jugendliche an Krebs – die häufigsten Formen sind Blutkrebs (Leukämien), Hirntumoren sowie Tumoren des Lymphgewebes. Karzinome, die bei Erwachsenen mehr als 90 Prozent der Neuerkrankungen ausmachen, kommen dagegen selten vor. Die Diagnose Krebs ist für die Familien zutiefst einschneidend und stellt den Lebensalltag auf den Kopf. Die Behandlung zieht sich in der Regel über Wochen und Monate hin. Die verschiedenen Therapieformen stellen eine außerordentlich starke Belastung für die jungen Patienten dar. Akute Nebenwirkungen treten mit hoher Wahrscheinlichkeit auf. Besorgniserregend sind auch die zunehmend diagnostizierten, teilweise gravierenden Spätfolgen der Strahlen- und Chemotherapie von Krebserkrankungen im Kindesalter. Generell konnten dank erfolgreicher Forschung in den letzten Jahrzehnten große Erfolge bei der Bekämpfung kindlicher Krebserkrankungen erzielt werden. Heute sind die Erkrankungen in vielen Fällen heilbar: Etwa 80 Prozent aller Betroffenen überleben. Das ist ein großer Erfolg, wenn man bedenkt, dass diese Kinder noch bis vor wenigen Jahrzehnten kaum Überlebenschancen hatten. Gleichwohl sterben auch heute noch zu viele Kinder an Krebs oder erfahren durch die Erkrankung oder die Behandlungsmethoden schwerwiegende Einbußen ihrer Lebensqualität.
Mit dem Juli-Harnack-Stipendium* ermöglicht die Fördergemeinschaft Kinderkrebs-Zentrum Hamburg e,V. jedes Jahr vier MedizinstudentInnen, ein Jahr lang am Forschungsinstitut Kinderkrebs-Zentrum Hamburg zu arbeiten und ihre medizinische Doktorarbeit im Bereich der pädiatrischen Onkologie zu schreiben. Eine Stipendiatin ist Esther Monsees. Sie ist Medizinstudentin am UKE und medizinische Doktorandin an unserem Institut. Besonders gut gefällt ihr, dass sie aktiv dazu beitragen kann, den Kinderkrebs zu knacken und dabei Teil einer motivierenden Gemeinschaft ist.
*Das Stipendium wurde nach Julian „Juli“ Harnack benannt, der 2006 im Alter von 16 Jahren an einem Hirntumor starb. In Gedenken an den leidenschaftlichen Hockeyspieler Juli organisiert sein ehemaliger Verein, der Uhlenhorster Hockey-Club (UHC), seit 2007 ein Hockeyturnier. Die Erlöse des mittlerweile nationalen Turniers kommen der Krebsforschung zugute. Mit dem 2018 ins Leben gerufenem Juli-Harnack-Stipendium möchte die Familie Harnack gemeinsam mit dem Forschungsinstitut gezielt Nachwuchswissenschaftler/innen für die Kinderkrebsforschung gewinnen.
Forschende Ärzte – die Clinician Scientist-Beschreibung trifft auf Dr. Catena Kresbach voll und ganz zu. Die Assistenzärztin ist neben ihrer Tätigkeit am Institut für Neuropathologie am Universitätsklinikum Hamburg-Eppendorf (UKE) zudem als Wissenschaftlerin am Forschungsinstitut Kinderkrebs-Zentrum Hamburg aktiv. Hier forscht sie zu Krankheitsursachen und Behandlungsmöglichkeiten kindlicher Hirntumoren, um die Erkankung besser zu verstehen und zukünftig besser behandeln zu können.
Das Forschungsinstitut Kinderkrebs-Zentrum Hamburg ermöglicht Clinician Scientists die gezielte Forschung im Bereich Leukämien, Hirntumore, zelluläre Therapien sowie Forschung im Bereich der Stammzelltransplantation.
Die Stelle von Frau Dr. Kresbach wird zudem anteilig durch ein Stipendium des Mildred Scheel Nachwuchzentrums Hamburg finanziert.
Hirntumoren gehören zu den zweithäufigsten Krebserkrankungen bei Kindern. Ihre enorme biologische Heterogenität und Komplexität stellen Forscher wie Kliniker vor große Herausforderungen, zumal bislang bei vielen Entitäten das grundlegende Wissen über biologische und klinische Merkmale fehlt. Ein Beispiel sind hochgradige Gliome – Tumoren des Zentralnervensystems, die infolge einer Entartung von Zellen des Gehirns oder Rückenmarks entstehen, oftmals schnell und aggressiv wachsen und mitunter schwer zu therapieren sind.
Am Forschungsinstitut Kinderkrebs-Zentrum Hamburg beschäftigt sich Professor Dr. Schüller und sein Team mit den komplexen genetischen und epigenetischen Merkmalen kindlicher Hirntumoren, um die Diagnostik zu verbessern und die Therapieoptionen für betroffene Kinder langfristig zu verbessern. Im Rahmen einer aktuellen Studie, die von der Fachzeitschrift Nature Communications publiziert wurde, ist es der AG Schüller nun erstmals gelungen, hochmalignen Gliome der MYCN-Unterklasse (HGG-MYCN) zu modellieren und Einblicke in die Tumorgenese dieser sehr aggressiven Tumoren zu erhalten. Die in der Maus entstandenen Tumoren zeigen dabei sehr große histologische und molekulare Ähnlichkeiten zu den bei Kindern vorkommenden HGG-MYCN. Zur Etablierung von spezifisch wirksamen Therapien wurde anschließend ein Hochdurchsatz-Wirkstoffscreening durchgeführt, bei dem sowohl murine als auch menschliche Tumorzellen behandelt wurde.
„Unser Mausmodell ist vergleichbar mit dem menschlichen HGG-MYCN in Bezug auf Histologie, DNA-Methylierung und Genexpression und lässt auch Aussagen zur Wirksamkeit von Medikamenten zu“; erklärt Professor Ulrich Schüller. „So konnten wir feststellen, dass die Wirkstoffklassen Doxorubicin, Irinotecan und Etoposid einen größeren therapeutischen Effekt auf die Tumorzellen haben als andere uns zur Verfügung stehenden Substanzen. Wir hoffen, mit unseren Daten den Behandlungserfolg von Kindern mit einem hochgradigen Gliom langfristig verbessern zu können“.
Hier geht es zur aktuellen Publikation
Nahaufnahme der Tumorzellen eines murinen HGG-MYCN. Die Tumorzellen zeigen typische Zeichen eines bösartigen Tumors und weisen klare Ähnlichkeiten zu humanen HGG-MYCN auf.
Das Medulloblastom ist der häufigste bösartige Hirntumor im Kindesalter. Um ein Medulloblastom zu behandeln, ist eine sehr intensive multimodale Therapie notwendig, die sowohl die chirurgische Resektion, eine intensive Chemotherapie sowie in einigen Fällen eine Bestrahlung umfasst. Diese Therapie ist für die Kinder sehr belastend, hat zahlreiche Nebenwirkungen und führt zudem häufig zu schwerwiegenden negativen Auswirkungen auf die neurokognitive Entwicklung auch noch lange nach der Therapie.
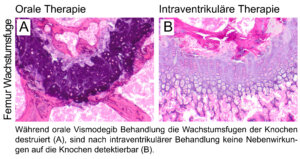
Dr. Catena Kresbach aus der Arbeitsgruppe von Prof. Dr. Ulrich Schüller hat in den letzten vier Jahren zusammen mit weiteren Wissenschaftlern intensiv an der Erforschung eines innovativen therapeutischen Ansatzes für die Medulloblastom Behandlung gearbeitet. In einem Mausmodell für kindliche Medulloblastome untersuchten sie die Wirkung eines Moleküls namens Vismodegib, das zielgerichtet einen Signalweg hemmt, der bei der Untergruppe der sogenannten Sonic-Hedgehog Medulloblastome überaktiviert ist.
Aus früheren Studien ist bekannt, dass oral (als Tablette) verabreichtes Vismodegib zwar sehr gute Ergebnisse bezüglich einer Tumorreduktion erzielt, bei Kindern allerdings schwerwiegende Nebenwirkungen an den Knochen hervorruft. Frau Dr. Kresbach und ihre KollegInnen konnten in ihren Untersuchungen zeigen, dass Injektion von Vismodegib in das Nervenwasser (sogenannte intraventrikuläre Therapie) zu einem deutlichen Rückgang der Tumorlast führt. Gleichzeitig konnte durch die intraventrikuläre Gabe verhindert werden, dass sich die Therapie negativ auf das Knochenwachstum auswirkt.
Da eine solche intraventrikuläre Therapie bei Kindern mit Medulloblastomen bereits für das Chemotherapeutikum Methotrexat routinemäßig in der Klinik durchgeführt wird, bildet die Arbeit von Frau Dr. Kresbach eine wertvolle Grundlage, um Vismodegib als künftige Therapie für Medulloblastome im Kindesalter zu behandeln. Die Arbeit wurde kürzlich in dem Journal Neuro-Oncology publiziert. Hier geht es zur Publikation.

Dr. Catena Kresbach ist "Clinician Scientist" und forscht am Kinderkrebs-Zentrum Hamburg intensiv im Bereich kindlicher Hirntumoren.
Mit dem von der Stoll VITA Stiftung finanzierten Brückenseminar bringen wir Kliniker und Wissenschaftler zusammen und ermöglichen den fachlichen Austausch mit internen und externen Experten.
Das letzte Brückenseminar fand am 20 September um am 20. August um 16.30 Uhr mit Dr. med. Dr. rer. nat. Roland Imle vom DKFZ/Kindertumorzentrum Heidelberg, der über seine aktuelle Forschungsarbeit im Bereich pädiatrischer Hirntumoren sprach. Host dieser Veranstaltung war Prof. Dr. Ulrich Schüller. Die nächsten Termine werden bald hier bekannt gegeben.
REFERENT: Dr. med. Dr. rer. nat. Roland Imle, DKFZ / Kindertumorzentrum Heidelberg
VORTRAG: "Somatic muscle engineering for flexible in vivo modeling of childhood sarcoma"
DATUM: 20. September 2023, 16.30 Uhr
ORT: Kinder-UKE, Hörsaal O47 (Orthopädie)

Anfang September fand das Event „Rudern gegen Krebs“ statt, eine von der Stiftung Leben mit Krebs in Kooperation mit dem UCCH und der Ruder-Gesellschaft HANSA e.V. ausgetragene Benefizregatta. MitarbeiterInnen des Forschungsinstituts Kinderkrebs-Zentrum Hamburg waren dabei, um auch auf Krebs im Kindesalter und die Notwendigkeit der gezielten Kinderkrebsforschung aufmerksam zu machen. Mit am Start dieses Jahr waren Arbeitsgruppenleiter Professor Dr. Ulrich Schüller und Professor Ingo Müller, die gemeinsam mit dem Direktor sowie stellvertretenden Direktor der Klinik für pädiatrische Hämatologie und Onkologie, Prof. Stefan Rutkowski und Professor Wilhelm Wössmann, für die gute Sache antraten.
#knackdenkrebs #knackdieletzten20 #teamknackdieletzten20

![]()


Rudern gegen Krebs. Der Film
Verbesserung von Diagnostik und Therapiemonitoring durch Liquid Biopsy
Hirntumoren gehören zu den großen Herausforderungen der pädiatrischen Onkologie. Sie zeichnen sich durch eine enorme biologische Heterogenität aus und führen aufgrund ihres häufig aggressiven Verlaufes die Spitze der krebsbedingten Sterblichkeitsrate bei Kindern an. Professor Dr. Ulrich Schüller und seinem Team vom Forschungsinstitut Kinderkrebs-Zentrum Hamburg ist es in enger Zusammenarbeit mit weiteren Forschungsgruppen, u.a. mit dem Universitätsklinikum Hamburg-Eppendorf (UKE) und dem Universitätsklinikum Schleswig Holstein (UKSH), gelungen, eine neue Diagnostik-Methode in die klinische Anwendung zu bringen, die die Versorgung von Patienten mit Hirntumoren schon bald nachhaltig verbessern könnte. Die Studienergebnisse werden aktuell in dem Fachjournal Clinical Chemistry (Oxford University Press) veröffentlicht.
Liquid Biopsy ermöglicht exakte molekulare Tumor-Einordnung
Gamechanger ist die sogenannte Nanopore-Sequenzierung – ein sicheres und zugleich schonendes Verfahren, welches an zellfreier DNA (cfDNA) aus dem Gehirnwasser (Liquor) des Patienten Tumorsignaturen nachweist. Erfasst werden tumorspezifische Änderungen von Kopienzahlprofilen und epigentische Veränderungen der DNA, die – nach Abgleich mit großen Datenbanken – eine exakte molekulare Einordnung möglich machen. Waren bislang aufwändige und risikobehaftete neurochirurgische Eingriffe wie Gewebe-Biopsien oder Resektionen notwendig, reichen den Forschern bei dieser Methode wenige Milliliter Hirn-/Rückenmarksflüssigkeit. „Dank der Liquor Biopsy-Methode können wir eine verlässliche Diagnose stellen – ohne belastenden Eingriff für das Kind,“ erläutert Prof. Dr. Ulrich Schüller und verweist auch auf Patienten mit inoperablen Tumoren, bei denen schon eine Gewebebiopsie mit einem besonders hohen Risiko verbunden wäre, z.B. solche mit Tumoren des Hirnstamms. Hier gibt die neuartige Hirnwasseranalytik diagnostische Sicherheit. „Bei Tumoren, die operiert werden müssen und können, ermöglicht die präoperative Diagnosemethode es uns zudem, die chirurgischen Eingriffe individueller zu planen und an der Tumorentität auszurichten“, ergänzt Ulrich Schüller.
Da die neue Methode zudem Nachweise über Resterkrankungen oder Rückfälle liefert, sind Ulrich Schüller und seine Kollegen optimistisch, dass die Nanopore Sequenzierung von cfDNA aus Liquorproben zukünftig auch ein wichtiger Baustein für das Monitoring von Kindern mit einem Hirntumor darstellt. Vorstellbar ist, dass Chemotherapien und Bestrahlung wieder aufgenommen werden, sobald ein Rückfall über das Gehirnwasser nachgewiesen wird – und nicht erst bei klinischer Symptomatik oder Nachweis in der Bildgebung. Die Technologie soll mittelfristig in klinische Studien implementiert werden, um Patienten basierend auf den molekularen Ergebnissen der Liquordiagnostik zu randomisieren. Die Ergebnisse der Studiendaten, die 129 Liquor-Proben von insgesamt 99 Patienten umfasst, sind hier nachzulesen.
Daten werfen ihre Schatten voraus. Forschungspreise im Vorfeld der Publikation
Die Relevanz der Daten zeigen gleich drei Forschungspreise, die den Wissenschaftlern des Forschungsinstituts Kinderkrebs-Zentrum Hamburg im Vorfeld der Veröffentlichung verliehen wurden. So erhielt Professor Schüller den Wissenschaftspreis 2023 von der Deutschen Gesellschaft für Liquordiagnostik und Klinischen Neurochemie e.V. (DGLN). Darüber hinaus wurde Ann-Kristin Afflerbach aus der Arbeitsgruppe Schüller der Young Investigators Bronze Award auf der 13. ISMRC (International Symposium on Minimal Residual Cancer) verliehen. Zudem erhielt die Doktorandin jüngst den begehrten Hubertus-Wald-Nachwuchsförderpreis des Universitären Cancer Centers Hamburg (UCCH).
Originalpublikation
Die Daten sind in der aktuellen Ausgabe des Fachjournals Clinical Chemistry publiziert. Hier geht es zur Publikation.

Verbessertes Monitoring kindlicher Hirntumoren durch Liquid Biopsie
Pressemitteilung
Die Pressemitteilung zu diesem Beitrag können Sie hier downloaden.
Mit dem von der Stoll Vita Stiftung finanzierten Brückenseminar bringen wir Kliniker und Wissenschaftler zusammen und ermöglichen den fachlichen Austausch mit internen und externen Experten.
Wir freuen uns auf das nächste Brückenseminar am 20. August um 16.30 Uhr mit Dr. med. Dr. rer. nat. Roland Imle vom DKFZ/Kindertumorzentrum Heidelberg, der über seine aktuelle Forschungsarbeit im Bereich pädiatrischer Hirntumoren spricht. Host dieser Veranstaltung ist Prof. Dr. Ulrich Schüller.
REFERENT: Dr. med. Dr. rer. nat. Roland Imle, DKFZ / Kindertumorzentrum Heidelberg
DATUM: 20. September 2023, 16.30 Uhr
ORT: Kinder-UKE, Hörsaal O47 (Orthopädie)
Prof. Dr. Ulrich Schüller ist als Oberarzt am Institut für Neuropathologie für die Diagnostik kindlicher Hirntumoren sowie für die molekulare Neuropathologie verantwortlich. Schwerpunkt seiner Forschung am Forschungsinstitut Kinderkrebs-Zentrum Hamburg ist die Entwicklungsneurobiologie kindlicher Hirntumoren und die Pädiatrische Neuroonkologie.
"Kindlichen Hirntumoren zeichnen sich durch eine große biologische Heterogenität aus und führen die Spitze der krebsbedingten Sterblichkeitsrate bei Kindern an. Viele Tumoren sind hochaggressiv, wir können beobachten, wie schnell sich die Zellen teilen oder das Gehirn infiltrieren. Die Vorstellung davon, dass Kinder unter solchen Tumoren leiden, dass solche Tumore das Leben der Kinder und ganzer Familien von heute auf morgen verändern und dass Kinder mitunter ein Leben lang unter den Folgen der Therapie leiden, ist furchtbar und bringt eine hohe Verantwortung mit sich. Wir als Wissenschaftler sehen uns in dieser Verantwortung, solche Tumoren besser zu verstehen und in der Konsequenz Substanzen zu identifizieren oder zu entwickeln, die das Tumorwachstum bremsen.“__Prof. Dr. Ulrich Schüller.

Prof. Dr. Ulrich Schüller